Гамма-глобулин против клещевого энцефалита представляет собой 10%-ный (±1%) раствор гамма-глобулина, изготовленного из иммунной сыворотки лошадей. А. Т. Кравченко с соавт. (1966) исследовали возможность использования для получения гамма-глобулина спиртового, риванолового и солевого методов и пришли к убеждению, что наилучшим способом фракционирования является метод Кона. Как указывают сотрудники Томского института вакцин и сывороток Н. Б. Плахова и А. И. Деева (1965), оптимальными условиями для выделения однородной фракции гамма-глобулина и большего его выхода следует считать положение, когда конечное значение pH после осаждения равно 6,4 (±0,2), а наилучшим условием для растворения гамма-глобулина из смеси глобулинов (II осаждение) является растворение в трех объемах физиологического раствора и 1,5 объемах (взятых в отношении к последнему) дистиллированной воды. Осаждение гамма-глобулина (III осаждение) следует осуществлять при pH 7,0. В последние годы в этом же институте. Н.Г. Турлянцева провела серию исследований по изысканию наиболее эффективного метода фракционирования белков сыворотки, содержащей специфические антитела против вируса клещевого энцефалита. Сравнительному изучению были подвергнуты 4 метода: спиртовый (осаждение на холоду), модифицированный риваноловый, риванол-спиртовый и спиртоферм. Основанием для выбора данных методов послужили отдельные положительные моменты их технологии, связанные у одних (модифицированный риваноловый и риванол-спиртовый) с сокращением длительности производственного процесса и исключением полностью или частично отрицательных температурных условий при фракционировании и в то же время обеспечивающие более полное извлечение гамма-глобулина, у других (спиртоферм) — с использованием ферментативного гидролиза белка в сочетании со спиртовым методом осаждения на холоду, который способствует снижению анафилактогенных свойств препарата. Сравнительная характеристика указанных методов показала, что из числа испытанных наиболее эффективным оказался риванол-спиртовый способ осаждения белков как по показателям выхода активного препарата, так и по степени его очистки. Из 1 л нативной сыворотки этим методом получено 54,0±3 дозы, или 162,9 мл гамма-глобулина, в то время как спиртовый и модифицированный риваноловый методы позволили извлечь из нативной сыворотки лошади соответственно 36,0±5 доз, или 108 мл и 33,6±13 дозы, или 100,8 мл препарата из такого же количества сыворотки. Незначительный выход гамма-глобулина получен при применении метода спиртоферм (26,0±16 доз, или 78 мл). Важно отметить и то, что препарат, изготовленный данными методами, отличался степенью очистки по примеси бета-фракции. Гамма-глобулин, выделенный риванол-спиртовым методом, в то же время был электрофоретически однородным. Остальные методы осаждения не обеспечивали получения однородного гамма-глобулина. Во всех сериях препарата имелась примесь бета-фракции, которая составляла для гамма-глобулина, изготовленного спиртовым методом, в среднем 17,3%, модифицированным риваноловым — 21,3% и спиртофермом — 25,3%. Эти данные позволили автору внести соответствующие дополнения в существующий технологический регламент и МРТУ-42, предусматривающие возможность получения тамма-глобулина против клещевого энцефалита риванол-спиртовым методом. Противоэнцефалитный гамма-глобулин не должен иметь следов альбумина, а содержание в готовом препарате остаточного спирта не должно превышать 4,5%. Препарат должен быть стерильным, бесцветным, прозрачным или слегка опалесцирующим, безвредным, апирогенным. Иметь индекс нейтрализации в опытах на белых мышах не ниже 10000 (показатель отрицательного логарифма 50%-ной летальности белых мышей в опыте не выше 3,2, при контроле не ниже 7,2), либо 1:320—1:640 по ЦПД50 (на клетках ПЭС) по нейтрализации 100—1000 ТЦД50 вируса. Титр антигемагглютининов должен быть не ниже 1:1280. 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 41 42 43 44 45 46 47 48 49 50 51 52 53 54 55 56 57 58 59 60 61 62 63 64 65 66 67 68 69 70 71 72 73 74 75 76 77 78 79 80 81 82 83 84 85 86 87 88 89 90 91 92 93 94 95 96 97 98 99 100 101 102 103 104 105 106 107 108 109 110 111 112 113 114 115 116 117 118 119 120 121 122 123 124 125 126 127 128 129 130 131 132 133 134 135 136 137 138 139 140 141 142 143 144 145 146 147 148 149 150 151 152 153 154 155 156 157 158 159 160 161 162 163 164 165 166 167 168 169 170 171 172 173 174 175 176 177 178 179 180 181 182 183 184 185 186 187 188 189 190 191 192 193 194 195 196 197 198 199 200 201 202 |
Гемоглобинозы
Биологическая активность белков находится в прямой зависимости от сохранности ПСБ. При замене хотя бы одной аминокислоты могут возникнуть различные патологии. Например, при даже незначительных изменениях в ППЦ Hb возникают аномальные гемоглобинозы. Их около 200. Гемоглобинозы делятся на две основные группы:
1) гемоглобинопатии;
2) талассемии.
Гемоглобинопатии – в их основе наследственное изменение структуры какой-либо цепи Hb. Например, серповидно-клеточная анемия (в основном в странах Южной Америки, Африки, Юго-Восточной Азии). Эритроциты в условиях низкого парциального давления принимают форму серпа. HbS после отдачи О2 (Полинг и авт.) превращается в плохо растворимую и выпадает в осадок в виде веретенообразных кристаллов, которые деформируют клетку и приводят к массивному гемолизу. Болезнь протекает остро и дети погибают в раннем возрасте. Причиной данной патологии является мутация в молекуле ДНК, кодирующей синтез -цепи Hb, где происходит замена только 1-ой аминокислоты – глу на вал в 6-м положении. Ежегодно погибает около 1 млн. человек.
Талассемии – в основе – генетическое нарушение синтеза какой либо ППЦ Hb. При нарушении синтеза b-цепи возникают b-талассемии. Наряду с HbА1 обр. до 15% HbА2 и до 60% HbF – происходит гиперплазия и разрушение костного мозга, поражение печени, селезенки, деформация черепа, тяжелая гемолитическая анемия. Эритроциты приобретают форму мишени.
ЛЕКЦИЯ 3
Методы выделения и очистки белков.
Выделение и очистка белков осуществляется поэтапно.
1. Гомогенизация – это тщательное измельчение объектов биохимического исследования до однородного, то есть гомогенного состояния, то есть белки подвергаются тщательной дезинтеграции вплоть до разрушения клеточной стенки.
При этом используют:
а) ножевые гомогенизаторы типа Уорринга;
б) пестиковые гомогенизаторы Поттера — Эльвегейма;
в) шаровые и валковые мельницы – для более плотных объектов;
г) метод попеременного замораживания и оттаивания, при этом разрыв клеточной стенки происходит под действием кристалликов льда;
д) метод «азотной бомбы» – под высоким давлением клетки насыщаются азотом, затем давление резко сбрасывают, выделяется газообразный азот, который как бы взрывает клетку изнутри;
е) УЗ, различные пресс — методы, переваривание клеточных стенок ферментами. В большинстве случаев при гомогенизации выделяется тепло, при этом многие белки могут инактивироваться, поэтому все процедуры проводятся в холодных помещениях при t 0 или охлаждают сырье с помощью льда. При этом тщательно контролируют объем и время разрушения клеток, рабочее давление. Идеальным считается такой гомогенизат, который может подвергнуться дальнейшему экстрагированию.
2. Экстракция белков, то есть их перевод в растворенное состояние; чаще всего экстракцию проводят вместе с измельчением одновременно. Экстракцию проводят:
а) растворением в 8-10% растворах солей;
б) с использованием буферных растворов с рН от кислых до слабощелочных (боратных, фосфатных, цитратных, трис — буферных: смесь трисаминометана с NH2 – CH3 + HCl;
в) осаждение белков органическими растворителями (этанол, метанол, бутанол, ацетон и их комбинациями), при этом происходит расщепление белково-липидных и белково-белковых компонентов, то есть разрушение ЧСБ.
3.
а) высаливание – это процесс осаждения белков нейтральными солевыми растворами щелочных и щелочноземельных металлов.
Механизм высаливания – добавляемые анионы и катионы разрушают гидратную белковую оболочку белков, являющуюся одним из факторов устойчивости белковых растворов. Чаще всего применяются растворы сульфатов Na и аммония. Многие белки отличаются по размеру гидратной оболочки и величине заряда. Для каждого белка есть своя зона высаливания. После удаления высаливающего агента белок сохраняет свою биологическую активность и физико-химические свойства. В клинической практике применяется метод высаливания для разделения глобулинов ( при добавлении 50% раствора сульфата аммония (NH4)2SO4 выпадает осадок) и альбуминов ( при добавлении 100% раствора сульфата аммония (NH 4)2SO4 выпадает осадок).
На величину высаливания оказывают влияние:
1) природа и концентрация соли;
2) рН-среды;
3) температура.
Главную роль при этом играют валентности ионов. Поэтому действие соли оценивают по ионной силе раствора μ: , то есть ионная сила раствора (μ) равна произведению ½ концентрации каждого иона (С) на квадрат его валентности (V).
Метод Кона является разновидностью высаливания. Одновременно происходит экстракция и осаждения компонентов. Изменяя последовательно температуру (обычно низкие t –0+8С), рН раствора и концентрированного этанола, из плазмы крови последовательно выделяют до 18 фракций белков.
Метод Кона применяют в фармацевтическом производстве при получении кровезаменителей;
б) методы хроматографии. Основоположником разработки хроматографических методов анализа считается русский ученый Михаил Цвет (1903). В настоящее время существует много ее разновидностей. В основе метода лежит способность веществ специфически адсорбироваться на адсорбенте, заключенном в колонку или помещенном на каком-либо носителе. При этом происходит разделение анализируемых веществ и их концентрирование в строго определенном слое адсорбента. Затем через колонку пропускают соответствующие элюенты (растворители), которые ослабляют силы адсорбции и вымывают адсорбированные вещества из колонки. Вещества собираются в коллекторе фракций.
Основополагающим в хроматографии является коэффициент распределения, который равен отношению концентрации вещества в подвижной фазе к концентрации вещества в неподвижной фазе (или стационарной фазе).
Неподвижная стационарная фаза – может быть твердой или жидкой или смесью твердой и жидкой.
Подвижная фаза – жидкая или газообразная, она течет по стационарной, или пропускается через нее.
В зависимости от вида стационарной и подвижной фазы бывают различные модификации хроматографического анализа.
Адсорбционная – основана на различной степени адсорбции белков адсорбентом и растворимости их в соответствующем растворителе.
Применяемые адсорбенты – кремниевая кислота, Al2О3, CaCO3, MgO, древесный уголь. Адсорбент в виде суспензии с растворителем (чаще с буферным раствором) упаковывают в колонке (стеклянная вертикальная трубка). Образец наносят на колонку, затем через нее пропускают растворитель или смесь растворителей.
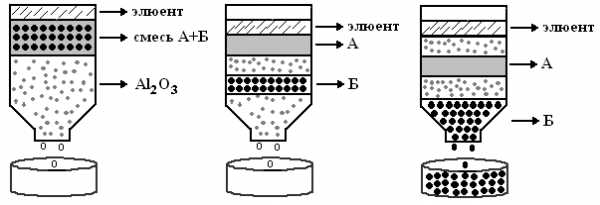
Разделение основано на том, что вещества с более высоким Краспр. (Б), продвигаются по колонке с большей скоростью. Сбор фракций осуществляется с помощью коллектора фракций.
Распределительная хроматография – основана на распределении смеси белков между двумя жидкими фазами. Разделение может происходить на специальной хроматографической бумаге, а также в колонках, как в адсорбционной. Твердая фаза в данном случае служит только опорой для жидкой стационарной фазы. Хроматографическая бумага обладает свойством задерживать воду между своими целлюлозными волокнами. Эта вода — неподвижная стационарная фаза. Когда по бумаге под действием капиллярных сил движется неводный растворитель (подвижная фаза), молекулы вещества, нанесенного на бумагу, распределяются между двумя фазами в соответствии с их коэффициентом распределения. Чем выше растворимость вещества в подвижной фазе, тем дальше оно продвинется по бумаге вместе с растворителем.
В случае распределения хроматографии на колонке – носители – это целлюлоза, крахмал, силикагель и др., неподвижная фаза – вода. При нанесении на колонку вещества смеси движутся по колонке с разной скоростью с учетом Краспр.
Rf для каждого соединения в стандартных условиях величина постоянная.
Ионообменная
хроматография – основана на притяжении противоположно
заряженных частиц. Для этого используют
различные ионообменные смолы: катионообменные – содержат отрицательно заряженные
группы – сульфированные стиролы  и КМЦ, которые притягивают положительно
заряженные ионы исследуемых веществ.
Их называют такжекислотными
ионообменниками.
и КМЦ, которые притягивают положительно
заряженные ионы исследуемых веществ.
Их называют такжекислотными
ионообменниками.
Анионообменные смолы, или основные ионообменники, содержат положительно заряженные группы, притягивающие отрицательно заряженные молекулы белков
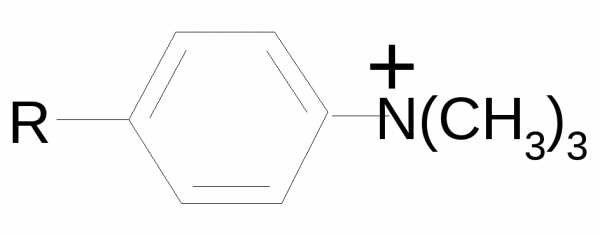 Триметиламиностирол,
это производное стиролов и целлюлозы.
Триметиламиностирол,
это производное стиролов и целлюлозы.
В зависимости от q разделяемых белков используют соответствующие ионообменники, с которыми взаимодействуют определенные белки, а другие беспрепятственно выходят из колонки. «Осажденные» на колонке белки снимают, используя более концентрированные солевые растворы или изменяя рН элюента.
Аффинная хроматография (или хроматография по сродству) основана на принципе избирательного взаимодействия белков или других макромолекул с иммобилизованными на носителях специфическими веществами – лигандами (это может быть кофермент, если выделяют фермент, антитело антиген и др. Благодаря высокой специфичности белков к иммобилизованным лигандам к нему присоединяется только один белок из смеси. Смывается буферными смесями с измененным рН или измененной ионной силой.
Достоинство – возможность одноэтапно выделить заданное вещество высокой степени чистоты.
Метод гель — фильтрации или метод молекулярных «сит» — это разновидность проникающей хроматографии.
Разделение молекул по размерам и форме основано на свойствах молекулярного сита, которые обладают многие пористые материалы, например органические полимеры с трехмерной сетчатой структурой, придающей им свойства гелей. Гель фильтрация – это разделение веществ с помощью гелей, основанное на различиях в размере молекул (сефароза, сефадекс, сефакрил, биогели и т.д.). Под действием эпихлоргидрина полисахаридные цепочки декстрана (синтезируется микроорганизмами) сшиваются в сетчатую структуру, становятся нерастворимыми в воде, но сохраняют к ней большое сродство. Благодаря этой гидрофильности полученные зерна (называемые сефадексом) сильно набухают с образованием геля, которым заполняют колонку. Метод основан на том, что крупные молекулы не проникают во внутреннюю водную фазу, а более мелкие молекулы сперва проникают в поры «сита», как бы застревают в них, а поэтому движутся с меньшей скоростью. Соответственно белки с большей Mr первыми поступают в приемник. В последнее время в проникающей хроматографии все чаще используют в качестве молекулярного сита пористые стеклянные гранулы.
Электрофоретический метод в биохимии – основан на различии скорости передвижения молекул в электрическом поле (аминокислоты, пептиды, белки, нуклеиновые кислоты).
Различие скорости движения зависит:
1. от q молекулы: подвижность молекул тем больше, чем больше суммарный q. Величина q зависит от рН;
2. от размеров молекул: чем крупнее молекулы, тем меньше их подвижность. Это связано с возрастанием сил трения и электростатических взаимодействий крупных молекул с окружающей средой;
3. от формы молекул: молекулы одинакового размера, но различной формы, например, фибрилл и глобул белка обладают различной скоростью. Это связано с различиями в силах трения и электростатического взаимодействия.
Виды электрофореза
а) Изоэлектрическое фокусирование. Разделение происходит на вертикальной колонке в град. как рН, так и напряжения. С помощью специальных носителей амфолитов в колонке устанавливается град. рН от 0 до 14. В колонку помещают смесь веществ, подключаю электроток. Каждый из компонентов движется к той части колонки, где значение рН соответствует его изоэлектрической точке и там останавливается, то есть фокусируется.
Достоинство: происходит разделение, очистка и идентификация белков в один прием. У метода высокая разрешительная способность (0,02 pI).
б) Изотахофорез – это электрофорез на поддерживающих средах. После включения электротока ионы с самой высокой подвижностью движутся к соответствующему электроду первыми, с самой низкой – последними, обладающие промежуточной подвижностью – располагаются посередине.
в) Диск-электрофорез – прибор состоит из двух сосудов с буфером – верхнего и нижнего, соединенных вертикальными трубками, содержащими разнопористый гель. По мере движения ионизированных частиц под действием электротока. Более высокая пористость – в верхней части геля.
г) Иммуноэлектрофорез – метод сочетающий электрофорез с иммунодиффузией (для обнаружения антигенов в сложных физиологических смесях). На специальный носитель перпендикулярно друг другу помещают смесь антигенов и смесь антител. При включении электротока они разделяются на индивидуальные вещества и диффундируют на гелевом носителе. В месте встречи антигена с соответствующим антителом происходит специфическая реакция преципитации в форме дуги. Количеств образовавшихся дуг соответствует количеству антигенов.
studfiles.net
Методы выделения и очистки белков — Мегаобучалка
Выделение и очистка белков осуществляется поэтапно.
1. Гомогенизация – это тщательное измельчение объектов биохимического исследования до однородного, то есть гомогенного состояния, то есть белки подвергаются тщательной дезинтеграции вплоть до разрушения клеточной стенки.
При этом используют:
а) ножевые гомогенизаторы типа Уорринга;
б) пестиковые гомогенизаторы Поттера — Эльвегейма;
в) шаровые и валковые мельницы – для более плотных объектов;
г) метод попеременного замораживания и оттаивания, при этом разрыв клеточной стенки происходит под действием кристалликов льда;
д) метод «азотной бомбы» – под высоким давлением клетки насыщаются азотом, затем давление резко сбрасывают, выделяется газообразный азот, который как бы взрывает клетку изнутри;
е) УЗ, различные пресс — методы, переваривание клеточных стенок ферментами. В большинстве случаев при гомогенизации выделяется тепло, при этом многие белки могут инактивироваться, поэтому все процедуры проводятся в холодных помещениях при t° 0° или охлаждают сырье с помощью льда. При этом тщательно контролируют объем и время разрушения клеток, рабочее давление. Идеальным считается такой гомогенизат, который может подвергнуться дальнейшему экстрагированию.
2. Экстракция белков, то есть их перевод в растворенное состояние; чаще всего экстракцию проводят вместе с измельчением одновременно. Экстракцию проводят:
а) растворением в 8-10% растворах солей;
б) с использованием буферных растворов с рН от кислых до слабощелочных (боратных, фосфатных, цитратных, трис — буферных: смесь трисаминометана с NH2 – CH3 + HCl;
в) осаждение белков органическими растворителями (этанол, метанол, бутанол, ацетон и их комбинациями), при этом происходит расщепление белково-липидных и белково-белковых компонентов, то есть разрушение ЧСБ.
3. Очистка и фракционирование белков. После экстрагирования производят разделение или фракционирование смеси на индивидуальные белки и их дальнейшую очистку:
а) высаливание – это процесс осаждения белков нейтральными солевыми растворами щелочных и щелочноземельных металлов.
Механизм высаливания – добавляемые анионы и катионы разрушают гидратную белковую оболочку белков, являющуюся одним из факторов устойчивости белковых растворов. Чаще всего применяются растворы сульфатов Na и аммония. Многие белки отличаются по размеру гидратной оболочки и величине заряда. Для каждого белка есть своя зона высаливания. После удаления высаливающего агента белок сохраняет свою биологическую активность и физико-химические свойства. В клинической практике применяется метод высаливания для разделения глобулинов ( при добавлении 50% раствора сульфата аммония (NH4)2SO4 выпадает осадок) и альбуминов ( при добавлении 100% раствора сульфата аммония (NH4)2SO4 выпадает осадок).
На величину высаливания оказывают влияние:
1) природа и концентрация соли;
2) рН-среды;
3) температура.
Главную роль при этом играют валентности ионов. Поэтому действие соли оценивают по ионной силе раствора μ: , то есть ионная сила раствора (μ) равна произведению ½ концентрации каждого иона (С) на квадрат его валентности (V).
Метод Кона является разновидностью высаливания. Одновременно происходит экстракция и осаждения компонентов. Изменяя последовательно температуру (обычно низкие t° –0+8°С), рН раствора и концентрированного этанола, из плазмы крови последовательно выделяют до 18 фракций белков.
Метод Кона применяют в фармацевтическом производстве при получении кровезаменителей;
б) методы хроматографии. Основоположником разработки хроматографических методов анализа считается русский ученый Михаил Цвет (1903). В настоящее время существует много ее разновидностей. В основе метода лежит способность веществ специфически адсорбироваться на адсорбенте, заключенном в колонку или помещенном на каком-либо носителе. При этом происходит разделение анализируемых веществ и их концентрирование в строго определенном слое адсорбента. Затем через колонку пропускают соответствующие элюенты (растворители), которые ослабляют силы адсорбции и вымывают адсорбированные вещества из колонки. Вещества собираются в коллекторе фракций.
Основополагающим в хроматографии является коэффициент распределения, который равен отношению концентрации вещества в подвижной фазе к концентрации вещества в неподвижной фазе (или стационарной фазе).
Неподвижная стационарная фаза – может быть твердой или жидкой или смесью твердой и жидкой.
Подвижная фаза – жидкая или газообразная, она течет по стационарной, или пропускается через нее.
В зависимости от вида стационарной и подвижной фазы бывают различные модификации хроматографического анализа.
Адсорбционная – основана на различной степени адсорбции белков адсорбентом и растворимости их в соответствующем растворителе.
Применяемые адсорбенты – кремниевая кислота, Al2О3, CaCO3, MgO, древесный уголь. Адсорбент в виде суспензии с растворителем (чаще с буферным раствором) упаковывают в колонке (стеклянная вертикальная трубка). Образец наносят на колонку, затем через нее пропускают растворитель или смесь растворителей.
Разделение основано на том, что вещества с более высоким Краспр. (Б), продвигаются по колонке с большей скоростью. Сбор фракций осуществляется с помощью коллектора фракций.
Распределительная хроматография – основана на распределении смеси белков между двумя жидкими фазами. Разделение может происходить на специальной хроматографической бумаге, а также в колонках, как в адсорбционной. Твердая фаза в данном случае служит только опорой для жидкой стационарной фазы. Хроматографическая бумага обладает свойством задерживать воду между своими целлюлозными волокнами. Эта вода — неподвижная стационарная фаза. Когда по бумаге под действием капиллярных сил движется неводный растворитель (подвижная фаза), молекулы вещества, нанесенного на бумагу, распределяются между двумя фазами в соответствии с их коэффициентом распределения. Чем выше растворимость вещества в подвижной фазе, тем дальше оно продвинется по бумаге вместе с растворителем.
В случае распределения хроматографии на колонке – носители – это целлюлоза, крахмал, силикагель и др., неподвижная фаза – вода. При нанесении на колонку вещества смеси движутся по колонке с разной скоростью с учетом Краспр.
Rf для каждого соединения в стандартных условиях величина постоянная.
Ионообменная хроматография – основана на притяжении противоположно заряженных частиц. Для этого используют различные ионообменные смолы: катионообменные – содержат отрицательно заряженные группы – сульфированные стиролы и КМЦ, которые притягивают положительно заряженные ионы исследуемых веществ. Их называют также кислотными ионообменниками.
Анионообменные смолы, или основные ионообменники, содержат положительно заряженные группы, притягивающие отрицательно заряженные молекулы белков
Триметиламиностирол, это производное стиролов и целлюлозы.
В зависимости от q разделяемых белков используют соответствующие ионообменники, с которыми взаимодействуют определенные белки, а другие беспрепятственно выходят из колонки. «Осажденные» на колонке белки снимают, используя более концентрированные солевые растворы или изменяя рН элюента.
Аффинная хроматография (или хроматография по сродству) основана на принципе избирательного взаимодействия белков или других макромолекул с иммобилизованными на носителях специфическими веществами – лигандами (это может быть кофермент, если выделяют фермент, антитело антиген и др. Благодаря высокой специфичности белков к иммобилизованным лигандам к нему присоединяется только один белок из смеси. Смывается буферными смесями с измененным рН или измененной ионной силой.
Достоинство – возможность одноэтапно выделить заданное вещество высокой степени чистоты.
Метод гель — фильтрации или метод молекулярных «сит» — это разновидность проникающей хроматографии.
Разделение молекул по размерам и форме основано на свойствах молекулярного сита, которые обладают многие пористые материалы, например органические полимеры с трехмерной сетчатой структурой, придающей им свойства гелей. Гель фильтрация – это разделение веществ с помощью гелей, основанное на различиях в размере молекул (сефароза, сефадекс, сефакрил, биогели и т.д.). Под действием эпихлоргидрина полисахаридные цепочки декстрана (синтезируется микроорганизмами) сшиваются в сетчатую структуру, становятся нерастворимыми в воде, но сохраняют к ней большое сродство. Благодаря этой гидрофильности полученные зерна (называемые сефадексом) сильно набухают с образованием геля, которым заполняют колонку. Метод основан на том, что крупные молекулы не проникают во внутреннюю водную фазу, а более мелкие молекулы сперва проникают в поры «сита», как бы застревают в них, а поэтому движутся с меньшей скоростью. Соответственно белки с большей Mr первыми поступают в приемник. В последнее время в проникающей хроматографии все чаще используют в качестве молекулярного сита пористые стеклянные гранулы.
Электрофоретический метод в биохимии – основан на различии скорости передвижения молекул в электрическом поле (аминокислоты, пептиды, белки, нуклеиновые кислоты).
Различие скорости движения зависит:
1. от q молекулы: подвижность молекул тем больше, чем больше суммарный q. Величина q зависит от рН;
2. от размеров молекул: чем крупнее молекулы, тем меньше их подвижность. Это связано с возрастанием сил трения и электростатических взаимодействий крупных молекул с окружающей средой;
3. от формы молекул: молекулы одинакового размера, но различной формы, например, фибрилл и глобул белка обладают различной скоростью. Это связано с различиями в силах трения и электростатического взаимодействия.
Виды электрофореза
а) Изоэлектрическое фокусирование. Разделение происходит на вертикальной колонке в град. как рН, так и напряжения. С помощью специальных носителей амфолитов в колонке устанавливается град. рН от 0 до 14. В колонку помещают смесь веществ, подключаю электроток. Каждый из компонентов движется к той части колонки, где значение рН соответствует его изоэлектрической точке и там останавливается, то есть фокусируется.
Достоинство: происходит разделение, очистка и идентификация белков в один прием. У метода высокая разрешительная способность (0,02 pI).
б) Изотахофорез – это электрофорез на поддерживающих средах. После включения электротока ионы с самой высокой подвижностью движутся к соответствующему электроду первыми, с самой низкой – последними, обладающие промежуточной подвижностью – располагаются посередине.
в) Диск-электрофорез – прибор состоит из двух сосудов с буфером – верхнего и нижнего, соединенных вертикальными трубками, содержащими разнопористый гель. По мере движения ионизированных частиц под действием электротока. Более высокая пористость – в верхней части геля.
г) Иммуноэлектрофорез – метод сочетающий электрофорез с иммунодиффузией (для обнаружения антигенов в сложных физиологических смесях). На специальный носитель перпендикулярно друг другу помещают смесь антигенов и смесь антител. При включении электротока они разделяются на индивидуальные вещества и диффундируют на гелевом носителе. В месте встречи антигена с соответствующим антителом происходит специфическая реакция преципитации в форме дуги. Количеств образовавшихся дуг соответствует количеству антигенов.
megaobuchalka.ru
15.5. Сравнение методов Хартри-Фока и Кона-Шама.
5
талям, что оправдывает их использование в качестве пробной волновой функции даже в таких проблемных методах как CASSCF.
Коррекция к кинетической энергии TC в методеКона-Шамапросто включается в обменный членK и, таким образом, полная электронная энергия в теории функционала плотности вычисляется в виде:
EDFT[ρ] = TS[ρ] + Ene[ρ] + J[ρ] + EXC[ρ],
TS – кинетическая энергия, рассчитываемая с помощью детерминанта Слэтера (S), составленного из орбиталейКона-Шама;EXC – корреляционнообменный функционал, причем обменный член дает больший вклад (напри-
мер, для атома Ne EX = -12.11a.e.,EC = -0.39a.e.).
Как видно из предыдущего обсуждения и уравнения для полной энергии EDFT, для точного решения многоэлектронной задачи осталось найти корре-ляционно-обменнуюэнергию, включающую в себя, как видно из названия, энергию электронной корреляции. Другими словами, теория функционала плотности, несмотря на однодетерминантное представление волновой функции, учитывает корреляционную энергию и, в принципе, способна это сделать точно. Единственная проблема состоит в том, что вид корреляционнообменного функционала неизвестен, а потому необходимо искать его приближенное описание. Прежде чем познакомиться с существующими подходами к описаниюEXC дадим краткую сравнительную характеристику теорийХартри-Фокаи функционала плотности.
Как отмечено выше, обе теории имеют очень похожий математический аппарат, основаны на вариационном принципе, используют итерационную процедуру и имеют примерно одинаковую затратность порядка N4. В то же время, между методомХартри-Фокаи DFT существуют и принципиальные различия, которые сформулируем в виде вопросов:
1. Возможно лив принципе получение точного решения?Если бы было известно точное значение EXC, DFT давала бы возможность вычислить точное значение полной энергии, включающее электронную корреляцию. И это при таких же вычислительных затратах, как и для расчета некоррелированной хартри-фоковской энергии! Правда не исключено, что точный EXC[ρ] функционал может быть настолько сложным, что вычислительные затраты станут сопоставимыми с таковыми для точного решения уравнения Шредингера традиционными методами волновой механики. Метод Хартри-Фока в принципе не способен дать точного решения волнового уравнения, а достижим лишь хартри-фоковский предел (см. раздел 12.6 и 13.1).
2. Строго ли решаются уравнения теории?В методе Хартри-Фока система одноэлектронных уравнений решается строго, т.к. итерационная процедура в принципе позволяет достичь любого разумно малого порога сходимости решения. Хотя в DFT приближениях также используется процедура самосогласования, элементы матрицы Кона-Шама рассчитываются приближенно, нестрого, т.к. неизвестен точный вид корреляционно-обменного функционала.
studfiles.net
15.6. Корреляционно-обменный функционал.
6
Поскольку точный вид EXC[ρ] пока неизвестен, актуальным является вопрос: какие вычислительные затраты необходимы для получения результата заданной точности? В этом отношении методы DFT выглядят чрезвычайно привлекательными.
Оказывается возможным доказать, что обменно-корреляционныйпотенциал является уникальным функционалом, строгим для всех систем. Однако конкретный вид этого потенциала неясен. Различные DFT методы отличаются друг от друга только выбором формыEXC[ρ] функционала, наличием различных наборов подгоночных параметров.
Обычным подходом является разделение EXC на обменныйEX и корреляционныйEC потенциалы, хотя строгость такого разделения не установлена:
EXC [ρ]= EX [ρ]+ EC [ρ]= ∫ρ(r)εX (ρ(r))dr +∫ρ(r)εC (ρ(r))dr.
15.6.1. Приближение локальной плотности.
Предложено несколько вариантов конкретного вида функционалов EX иEC. В ранних и более простых вариантах DFT использовали приближениело-
кальной плотности (или более общий случай – локальной спиновой плотно-
сти – Local Spin Density Approximation, LSDA), предполагающее, что локаль-
но электронная плотность представляет собой однородный электронный газ, что эквивалентно медленно изменяющейся функции плотности. Обменная энергия вычисляется по формуле Дирака:
εXLSDA [ρ] = −21/ 3CX (ρα1/ 3+ ρ1β/ 3),
коэффициент CX имеет тот же смысл, что и приведенный в разделе 15.3. Это же уравнение может быть записано в терминах общей плотности и
спиновой поляризации ζ:
εXLSDA[ρ] = −21/ 3CX ρ1/ 3[(1+ζ )4 / 3+(1−ζ )4 / 3], ζ | = | ρα− ρβ | . |
| |||
|
| ρα+ ρβ | |
Корреляционную энергию однородного электронного газа рассчитывают по аналитической интерполяционной формуле Воско, Уилка и Нюсэ (Vosko, Wilk, Nusair), содержащей неполяризованную (ζ = 0) и поляризованную (ζ = 1) составляющие:
|
| εVWN | (r ,ζ ) | = ε |
| (r ,0) | +ε |
|
| (r | ) | f (ζ ) | (1 −ζ 4 )+ |
| ||||
|
|
|
|
|
|
| ||||||||||||
|
| C | S |
|
| c | S |
|
| a | S |
| ′′ |
|
| |||
|
|
|
| +[ε |
|
|
|
|
|
|
|
|
|
| f (0) |
|
| |
|
|
|
| c | (r | ,1) −ε | c | (r |
| ,0)]f (ζ )ζ 4 , |
|
| ||||||
|
| 3 1/ 3 |
| S |
| S |
|
|
|
|
|
|
| |||||
|
|
|
|
|
|
| (1 +ζ ) | 4 / 3 + (1 −ζ )4 / 3− 2 |
| |||||||||
где r | = |
|
| и |
|
| f (ζ )= |
|
|
|
|
|
|
|
|
| . | |
|
|
|
|
|
|
|
| 2(21/ 3− | 1) | |||||||||
S |
| 4πρ |
|
|
|
|
|
|
|
|
|
|
| |||||
7
Функционалы εc иεa определяются по формулам, содержащим ряд подгоночных параметров. Так согласно формуле, предложенной Пердью и Ван-
гом (Perdew, Wang, 1991, PW91):
PW 91 |
| 2 |
|
|
| 1 |
|
|
|
|
| |
= −2aρ(1 +αx |
|
|
|
|
|
|
|
| ||||
εc/ a |
| ) ln 1 | + |
|
|
|
|
|
|
| , | |
| 2a(β1 x+ β2 x | 2 | + β3 x | 3 | + β4 x | 4 |
| |||||
|
|
|
|
|
|
|
| ) | ||||
где x = rS1/2;a, α, β1, β2, β3, β4 – некоторые константы.
Точность методов, основанных на приближении LSDA сопоставима с точностью хартри-фоковскихметодов.
15.6.2. Методы градиентной коррекции.
Более точные результаты дают методы градиентной коррекции (Generalized Gradient Approximation, GGA), связывающиеEX иEC не только с плотно-
стью ρ, но и с ее первой (ρ) и второй (2ρ) производными. Было предложено несколько функциональных зависимостей в виде поправок к LSDA функционалам. Например, обменная поправка Бекке (Becke, 1988):
εXB88 | = εXLDA + ∆εXB88 , ∆εXB88 | = −βρ1/ 3 |
| x2 | , x = |
| ρ |
|
| . | |
|
|
| |||||||||
|
|
|
|
|
| ||||||
1+ 6βx sinh−1 x | ρ4 / 3 | ||||||||||
|
|
|
|
| |||||||
Параметр β подобран по известным данным для атомов. Также широко используется обменный и корреляционный функционалы с поправками, определенными Пердью и Вангом. Например, формула для обменного функционала имеет вид:
PW 91 |
|
| 1 | + xa1 sinh | −1 | (xa2 )+ (a3 + a4 exp(−bx | 2 | )x | 2 | ) |
| ||||
LDA |
|
|
|
| |||||||||||
εX | = εX |
|
|
|
|
|
|
|
|
|
|
|
|
| , |
|
| 1 + xa1 sinh | −1 | (xa2 ) + a5 x | 2 |
|
|
|
| ||||||
|
|
|
|
|
|
|
|
|
|
|
| ||||
где a1-5 иb – подобранные константы, аx имеет тот же смысл, что и в предыдущем уравнении. Корреляционный функционал имеет вид:
εCPW91 = εCLDA+ ∆εCPW91.
Аналитическую формулу для поправки к корреляционному функционалу PW91 ∆εCPW 91 можно найти в специальной литературе.
Также был предложен ряд функционалов с градиентной коррекцией (не поправок!). Например, один из наиболее популярных корреляционных функционалов предложен Ли, Янгом и Парром (Lee, Yang, Parr, LYP):
| ρ |
| ρ |
| ρ | α | ρ | α | X + | 2 | ρ2 | ( | ρα |
| 2 | + |
| ρβ |
| 2 | ||||
|
|
|
|
|
| |||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
| ||||||||||||
εCLYP= −4a | α | α |
| 18 |
| 3 |
|
|
| |||||||||||||||
|
|
| − abω |
|
|
|
|
|
|
|
|
|
|
|
|
| ||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| |||||||
| ρ2(1 | + dρ−1/ 3) | − ρ 2 )− | (ρα2 ρβ | 2 + ρβ2 ρα |
| ||||||||||||||||||
X=144(22 / 3)CF (ρα8 / 3+ ρβ8 / 3)+(47 −7δ) ρ 2 −(45 −δ) ×
×( ρα2 + ρβ2 )+ 2ρ−1 (11−δ)(ραρα2 + ρβρβ2 ),
|
|
| 8 |
|
|
|
ω = | exp(−cρ−1/ 3 ) | , | δ = cρ1/ 3 + |
| dρ−1/ 3 | , |
(1+ dρ−1/ 3)ρ14 / 3 |
| + dρ−1/ 3 | ||||
|
| 1 |
| |||
константа CF определена в разделе 15.3,a, b, c иd – параметры, определенные подгонкой к экспериментальным данным для атома гелия. Добавление нелокальных членов к LSDA функционалу заметно повышает качество расчетов как структурных параметров молекул, так и энергетических характеристик.
15.6.3. Гибридные методы.
Наконец, получили развитие так называемые гибридные методы, в которых в выражение для EX вносится вклад, рассчитываемый так же, как обменная энергия в методеХартри-Фока(только используются, конечно, орбиталиКона-Шама).
Например, трехпараметровый функционал Бекке (B3) – пример гибридного функционала:
EXCB3 = (1 − a)EXLSDA+ a EXHF+b ∆EXB88 + ECVWN+ c ∆ECGGA,
где хартри-фоковскаяобменная энергияEXHF с вкладомa входит в выраже-
ние для обменного функционала. Формулы для второго и четвертого членов суммы приведены в разделе 15.6.1, для третьего слагаемого – в разделе
15.6.2. Последний член суммы ∆ECGGA – есть градиентная коррекция корре-
ляционного функционала. В зависимости от вида поправки получается та или иная конкретная реализация DFT гибридного метода. Так, использование поправки Пердью и Ванга (GGA ≡ PW91) дает популярный метод B3PW91. В
наиболее используемом в настоящее время DFT методе вместо ∆ECGGA ис-
пользуется корреляционный функционал Ли, Янга и Парра LYP, приводя к известному акрониму B3LYP. Так как функционал LYP содержит и локальный, и нелокальный члены, то корреляционно-обменныйфункционал метода B3LYP в действительности имеет вид:
EXCB3LYP= (1 − a)EXLSDA+ a EXHF+ b ∆EXB88 + (1 − c)ECVWN+ c ECLYP,
a, b иc – константы, которые были подобраны Бекке с использованием надежных экспериментальных данных для репрезентативного набора сравнительно простых химических соединений (так называемыйG1-набор).
Другие примеры гибридных функционалов: MPW1PW91 – однопараметровый гибридный функционал с модифицированным обменным функционалом Пердью и Ванга и корреляционным функционалом PW91, данный DFT метод используется для расчета химических сдвигов и констант сверхтонкого взаимодействия спектров ЯМР с превосходной степенью точности; G961LYP – однопараметровый гибридный функционал с обменным функционалом Джилла G96 и корреляционным функционалом LYP и т.д.
Широкое практическое использование гибридных DFT методов обусловлено уникальным сочетанием низкой затратности приближения и высокой степени точности результатов расчетов, сравнимой (а иногда и превосхо-
studfiles.net
пять простых советов по уборке дома

Многие из нас посвящают весенние выходные уборке дома. Весна настраивает на «перезагрузку», хочется сбросить весь балласт, накопленный за темные зимние месяцы, впустить в квартиру воздух, вдохнуть полной грудью. Но часто уборка, начатая рано утром, почти не продвигается до самого вечера. Мы устаем, раздражаемся, чувствуем недовольство собой и отправляемся спать, задаваясь одним вопросом: «Чем же я занимался весь день?»
1. Уберите все одним махом
Не верьте советам о постепенной уборке помещения. Убирайте понемногу каждый день — и будете убирать вечно.
«Изменить привычки в области стиля жизни, приобретенные на протяжении многих лет, бывает крайне трудно. Если вы до сих пор не преуспели в сохранении порядка, то вскоре обнаружите, что почти невозможно приучить себя убирать понемногу. Большая уборка дает видимые результаты. Уборка никогда не лжет.
Если убирать одним махом, а не постепенно, то можно навсегда изменить свое мышление и жизненные привычки. Этот подход — ключ к предотвращению эффекта обратного действия. Делая все сразу, вы будете видеть результаты и чувствовать воздействия своих усилий», — советует Мари Кондо в своей книге «Магическая уборка. Японское искусство наведения порядка дома и в жизни».
2. Не позволяйте родным подглядывать
Убирайтесь, если это возможно, в одиночестве. И ни в коем случае не показывайте мужу, сестре или матери мешки с вещами, которые вы будете выбрасывать.
«Если это возможно, вынесите мешки с мусором самостоятельно, — пишет Мари Кондо. — Нет необходимости давать вашим родным знать, что именно вы собираетесь выбрасывать.
Дело не в том, что вам есть чего стыдиться. В уборке нет ничего плохого. Однако зрелище того, что выбрасывают их дети, — это сильнейший стресс для родителей. Сам объем мусорной кучи может вызвать у них тревогу, заставляя задуматься, смогут ли дети прожить с тем, что у них осталось. В подавляющем большинстве случаев именно матери «спасают» вещи, выброшенные дочерьми. Однако они редко носят одежду, которую забирают».
3. Одна категория — за один раз
У большинства людей предметы, которые попадают под одну категорию (например, одежда), хранятся в двух или более местах, разбросанных по всему дому. Именно поэтому принцип уборки «сначала спальня, потом гостиная, потом кухня» не работает.
«Скажем, к примеру, вы начинаете с платяного шкафа в комнате или комода, — описывает ситуацию Мари. — После того как вы закончите сортировать и выбрасывать то, что хранится в нем, вы непременно наткнетесь на одежду, которую держали в другом шкафу, или наброшенную на кресло в гостиной. Вам придется повторить все усилия, а это может убить мотивацию».
Вместо этого можно разбирать по одной категории вещей за один раз. Например, соберите всю одежду в доме и положите ее на пол в гостиной. Вытащите все из мешка с грязными вещами, шкафа с прихожей, ящиков с сезонными и пляжными костюмами. А затем берите каждую вещь в руки и спрашивайте себя: «Доставляет ли это мне радость?» Если эта вещь делает вас счастливой, оставляйте ее. Если же это платье никаких эмоций у вас не вызывает, то от него не жалко избавиться. С большой вероятностью вы и носили его всего один раз, и то несколько лет назад.
4. Безжалостно избавляйтесь от документов
Документ документу рознь — уверена Мари Кондо. А это значит, что все бумаги в доме нужно для начала рассортировать на две кучи. Первая — это те документы, которые точно остаются. Это страховки, трудовые договоры и договоры по сдаче и найму квартиры, свидетельства о рождении и собственности и прочие документы, имеющие важную жизненную ценность.
А вторая стопка — это документы, с которыми надо разобраться. Из нее точно отправляются в мусор инструкции по использованию техники (к гарантиям это не относится, они должны быть в первой стопке). А также старые счета, выписки, чеки, билеты и купоны на скидку, которые давно просрочены. И постарайтесь не хранить бумаги горизонтально. Лучше приобретите для них жесткие вертикальные папки — так они не смогут вернуться к своему первоначальному хаотическому состоянию.
5. Сначала выбросьте, а потом наводите порядок
Большая ошибка, которую мы совершаем во время уборки, — одновременно убираться и избавляться от ненужных вещей. Самый эффективный и быстрый способ — это сначала избавиться от ненужного, а уже после решать, куда и как положить оставшиеся вещи. И выносите мешок с мусором сразу, как только он будет заполнен. Это не позволит вам «дать слабину» и в последний момент вытащить из него и оставить в доме что-то ненужное.
Читайте также
www.psychologies.ru
уборка по-японски (часть 1) – Уборка и порядок
Книга Мари Кондо вышла на русском в конце августа. Поговорим о порядке в доме.
В конце августа в издательстве Эксмо вышла на русском языке книга «Магическая уборка. Японское искусство наведения порядка дома и в жизни». Команда Квартблога решила разобраться, почему эта книга стала мировым бестселлером за короткое время и чему новому может научить вас ее автор Мари Кондо.
 Об авторе: 30-летняя Мари Кондо — консультант по наведению порядка из Японии. С детства читала журналы по домоводству вместо игр с куклами и применяла полученные знания на практике. Является героиней ток-шоу на японском телевидении, очередь на консультацию к ней составляет несколько месяцев. Цифры: Мари вошла в топ-100 влиятельных людей мира по версии Time, продано более 3 млн копий книги.
Об авторе: 30-летняя Мари Кондо — консультант по наведению порядка из Японии. С детства читала журналы по домоводству вместо игр с куклами и применяла полученные знания на практике. Является героиней ток-шоу на японском телевидении, очередь на консультацию к ней составляет несколько месяцев. Цифры: Мари вошла в топ-100 влиятельных людей мира по версии Time, продано более 3 млн копий книги.
Сначала я хочу извиниться. Во-первых, перед своим главным редактором за то, что задержала статью, потому что всю прошлую неделю я проверяла теорию, описанную в книге, на собственном опыте. Во-вторых, перед читателями Квартблога — за качество фотографий: это не постановочные иллюстрации, это реальные фотоистории людей, найденные в Инстаграме по тегу #konmari.
В чем суть?
В своей книге Мари учит не тому, как часто нужно протирать пыль, какое средство лучше использовать для мойки окон и сколько времени вам понадобится, чтобы отдраить кухню после вечеринки. Ее стиль уборки по-настоящему масштабен и в определенном смысле разрушителен — для старых, отживших привычек и шаблонов поведения из прошлого. Результатом наведения порядка по методу КонМари (от первого слога фамилии и имени) практически всегда, по отзывам клиентов Мари, становятся серьезные изменения в жизни.
«Приводя свой дом в порядок, человек приводит в порядок свои дела и свое прошлое. В результате он вполне отчетливо понимает, что ему нужно в жизни, а что не нужно, чем стоит заниматься, а чем не стоит».


Главным секретом успеха в уборке Мари считает следующее (цитата): «Если убирать одним махом, а не постепенно, то можно навсегда изменить свое мышление и жизненные привычки». В уборке каждый день понемногу кроется серьезная проблема: такая уборка никогда не заканчивается; убираясь по чуть-чуть, по одному участку за раз, люди часто не видят моментальных результатов своего труда, им кажется, что их усилия напрасны. В то время как глобальная уборка в ограниченный период времени дает колоссальный заряд энергии, «перезагружает» мышление и выводит жизнь на новый уровень.
«Эффективная уборка включает всего два важнейших действия: избавиться от ненужного и определить, где хранить нужное».
Делай раз: Идеальная жизнь
По словам Мари, любую уборку следует начинать с цели. Спросите себя: что вы хотите получить, когда закончите? В какое место вы хотите возвращаться вечером с работы? Чем мечтаете заняться, после того, как переступите порог собственной квартиры или дома? Нарисуйте себе яркую живую картину в своем воображении, а потом спросите себя: зачем мне это? И так несколько раз подряд. Вы удивитесь, но конечным ответом на все эти «зачем?» будет: «Чтобы быть счастливым». Это самое главное, что мы все хотим в нашей жизни — быть счастливыми, и наш чистый дом поможет нам в этом.
Делай два: Выбросить ненужное
Мари Кондо делит уборку на две части: первая — выбросить все, что не приносит радости; вторая — найти место тому, что осталось. Понимаю, что это звучит очень категорично: «не приносит радости», но на самом деле, это правило — основное в методе Конмари. Объясню, почему: очень часто люди окружают себя множеством вещей, хранят что-то просто так или про запас и даже не задумываются, откуда у них возникает постоянное чувство тревоги или усталости. Даже когда они осознают, что являются владельцами слишком большого количества вещей, и решают от них избавиться, то выбрасывание по одному предмету за раз и вообще сосредоточенность на том, что нужно выбросить, по словам Мари, приводят к постоянному стрессу. Сосредоточиться нужно не на том, что вы хотите выбросить, а на том, что оставить. Это важно, потому что люди, окруженные любимыми вещами, перестают испытывать фоновое раздражение и чувствуют себя счастливее. Весь смысл в том, чтобы взять каждую вещь в руки: тело не обманывает вас, вы подсознательно поймете в первый же момент, радует ли вас эта вещь или нет, причем для каждого предмета реакция будет разной.
«В чем вообще состоит смысл уборки? Если не в том, чтобы наше пространство и содержащиеся в нем вещи дарили нам счастье, тогда, думается мне, в ней вообще нет никакого смысла».
Категории
Люди не склонны хранить предметы одного вида в определенном месте. По этой причине правило «убираться по зонам» не является достаточно эффективным: одежда, обувь, предметы домашнего обихода могут находиться в разных частях нашего дома; очень часто мы не имеем представления, сколько вещей у нас на самом деле. В своем методе Мари предлагает работать с категориями и делать это следующим образом: очень тщательно собирать предметы одной категории в одном месте и разбираться с ними. Порядок категорий в этом случае крайне важен: по словам Мари, начинать следует с самого простого типа вещей, по поводу которых легко принять решение, выбросить или оставить, и постепенно переходить к более значимым предметам. Порядок разбора вещей по методу Конмари таков: одежда, книги, документы, разное (начиная с дисков и заканчивая запасами продуктов), сентиментальные вещи (подарки, письма, сувениры из поездок и так далее), фотографии.
Разбирайте одну категорию за раз, по возможности ориентируясь на свое первое ощущение относительно каждого предмета. Если по какой-либо причине вы не можете решить, приносит ли вещь радость, то спросите себя: «Я не могу избавиться от этой вещи из-за привязанности к прошлому или из-за страха перед будущим?» Мари говорит, что каждый предмет в нашей настоящей жизни — это результат решений, которые мы приняли в прошлом. Всегда ориентируйтесь на себя настоящего — того, какой вы именно сейчас.
Во второй части этой статьи читайте о том, как правильно хранить то, что осталось, что такое вертикальное хранение и почему уборка — это настоящая магия.
Фотографии: Instagram, huffingtonpost.com
порядок в домеkvartblog.ru
